Princip činnosti baterie
Jak fungují nástěnné hodiny, televizní ovladač nebo rádiem řízená dětská hračka? Většina lidí bez váhání odpoví „z baterií“ a v zásadě budou mít pravdu. Je však nepravděpodobné, že by některý z nich dokázal říci, jak přesně je přenosná baterie ztrojnásobena, jak funguje a bez čeho by byl celý proces přenosu elektrického proudu z baterie ke konečnému spotřebiteli nemožný. Pojďme vyplnit tuto nepříjemnou mezeru ve znalostech.
Princip činnosti baterie
Abyste pochopili princip fungování běžné AA baterie, musíte mít obecné povědomí o její struktuře. Každá baterie se tedy skládá ze tří hlavních prvků - anody, katody a elektrolytu. Navíc mohou mít prakticky jakýkoli stav agregace: katoda a anoda umístěné ve fyziologickém roztoku jsou v zásadě také „baterií“, pouze ve formě, která je pro průměrného člověka neobvyklá.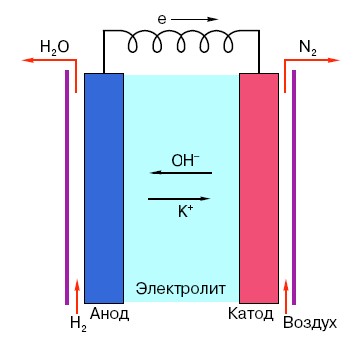
Zajímavý! Takzvaný „voltaický sloup“, který vynalezl Alessandro Volta, měl také všechny prvky potřebné pro výrobu elektrického proudu. Skládal se ze zinkových a měděných plátů naskládaných na sebe, mezi které byla jako „vrstva“ položena látka namočená v kyselině.
Anoda v takových systémech je hlavním zdrojem elektronů, které, jak víme ze školního kurzu fyziky, mají záporný náboj.Záporně nabité částice jsou přitahovány ke kladným a v tomto případě povrch katody působí jako „plus“.
Ale to nestačí, aby se objevil elektrický proud, protože elektrony potřebují také jakousi „dálnici“ - médium, které by podporovalo interakci katody a anody. Právě zde se „na scéně“ objevuje elektrolyt – sůl, zásada nebo kyselina schopná vést proud.
Podívejme se na princip fungování na konkrétním příkladu: existuje baterie s napětím 18 voltů. Napětí mezi elektrodami v něm je stabilní, dokud není připojen k síti. Jakmile se objeví spotřebitel (například obyčejná žárovka), napětí začne postupně klesat, proud začne proudit z „negativní“ elektrody na „kladnou“ a v elektrolytu nastane chemická reakce zaměřená na udržování rozdílu potenciálů mezi elektrodami.
Odkaz. Čím více energie spotřebitel potřebuje, tím intenzivnější je reakce uvnitř baterie a tím rychleji selže.
Jak funguje dobíjecí baterie, jak se liší od běžné
Podívali jsme se tedy na klasické „prstové“ a „malíčkové“ baterie a víme, že životnost většiny z nich je přísně omezena (bez ohledu na to, co říkají slavní výrobci). Jak je to ale s tzv. bateriemi – bateriemi bateriového typu, které dokážou energii při reakčním procesu nejen spotřebovávat, ale i akumulovat a dlouhodobě skladovat?
Abychom pochopili princip fungování baterie, je nutné se obrátit na chemii. Vezměme si jako příklad... Běžný oheň na dřevěné uhlí.Bez ohledu na to, jak krásný a fascinující plamen vypadá, každý chemik, který jej pozoruje, ví, že tento proces je pouze dlouhodobou reakcí oxidace paliva. Spalování uhlí interaguje s kyslíkem a v důsledku této reakce dostaneme:
- oxid uhličitý;
- světlo;
- teplý.
A pokud jsou poslední dva body schopny zahřát duši i tělo, tak oxid uhličitý nemůžeme nijak využít, protože je to vedlejší produkt reakce, který je ve skutečnosti jeho odpadem. Oxidační reakce se zastaví, když dojdou výchozí prvky: kyslík a uhlí. K zastavení reakce v baterii dochází úplně stejným způsobem, když jsou výchozí látky zcela vyčerpány a zůstává pouze „odpad“.
V baterii se vše děje trochu jinak. Faktem je, že reakce, která se v něm vyskytuje, patří do kategorie reverzibilních, to znamená, že za určitých podmínek může být „obrácena“ a vrátit všechny látky do původního stavu. Právě možnost vratné reakce probíhající v baterii umožňuje její nabíjení.
V baterii připojené k síti probíhá reakce v opačném směru a proud teče z „plus“ do „mínusu“ a ne naopak. Výsledkem je, že reakční produkt tvoří výchozí látky a majitel baterie dostává dostupnou „regenerovanou“ energii v přenosném formátu. To je vše!





